Bảng tuần hoàn các nguyên tố hóa học là một trong những chuyên đề trọng điểm của môn Hóa học trong chương trình trung học cơ sở và trung học phổ thông. Tuy nhiên để bạn ghi nhớ và áp dụng tốt bảng tuần hoàn các nguyên tố cần phải cần đến một phương pháp học hay. Sau đây là tổng hợp bảng tuần hoàn các nguyên tố hóa học 8 9 10 mới nhất cùng cách học hiệu quả.
Bạn đang xem: Bản nguyên tố hóa học
Lịch sử phát minh bảng tuần hóa các nguyên tố hóa học
Bảng tuần hóa các nguyên tố hóa học trải qua các cột mốc lịch sử quan trọng sau đây:
Từ thời Trung cổ, con người đã biết đến các nguyên tố vàng, bạc, đồng, chì, sắt, thuỷ ngân, lưu huỳnh.
1869, 63 nguyên tố được tìm ra, nhưng các nhà khoa học vẫn chưa lý giải được mối quan hệ giữa chúng.
1817, J. Dobereiner nhận thấy khối lượng nguyên tử của stronti ở giữa khối lượng nguyên tử của bari và canxi, bộ ba nguyên tố đầu tiên này có tính chất tương tự nhau.
1862, nhà địa chất Pháp De Chancourtois đã sắp xếp các nguyên tố hoá học theo chiều tăng của khối lượng nguyên tử lên một bằng giấy. Ông nhận thấy tính chất của các nguyên tố giống như tính chất của các con số, và chúng lặp lại sau mỗi 7 nguyên tố.
1864, nhà Hóa học Anh John Newlands đã tìm ra quy luật: Mỗi nguyên tố đều thể hiện tính chất tương tự như nguyên tố thứ 8 khỉ xếp theo khối lượng nguyên tử tăng dần.
1869, nhà bác học người Nga Dmitri Mendeleev đã công bố bản “bảng tuần hoàn các nguyên tố hoá học” đầu tiên. Nhà khoa học người Đức Lothar Mayer cũng đã đưa ra một bảng tuần hoàn các nguyên tố hoá học tương tự năm 1870.
Việc phát hiện định luật tuần hoàn này đã khai phá được bí mật của thế giới vật chất, khiến các nhà hóa học có được một vũ khí mạnh mẽ, có ý nghĩa quan trọng với sự phát triển của các ngành quang học vật lý học nguyên tử sau này.
Tính đến tháng 9 năm 2021, bảng tuần hoàn hóa học có tất cả 118 nguyên tố đã được xác nhận, bao gồm các nguyên tố từ 1 (Hidro) tới 118 (Oganesson).
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn hóa học
Trong bảng tuần hoàn các nguyên tố hoá học, các nguyên tố được sắp xếp theo 3 nguyên tắc như sau:
Nguyên tắc 1: Các nguyên tố xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
Nguyên tắc 2: Các nguyên tố giống nhau về lớp electron trong nguyên tử được xếp thành một hàng.
Nguyên tắc 3: Các nguyên tố có cùng số electron hóa trị trong nguyên tử được sắp xếp vào một nhóm. Electron hóa trị là những electron có khả năng tham gia hình thành liên kết hóa học (electron lớp ngoài cùng hoặc phân lớp kế ngoài cùng chưa bão hòa).
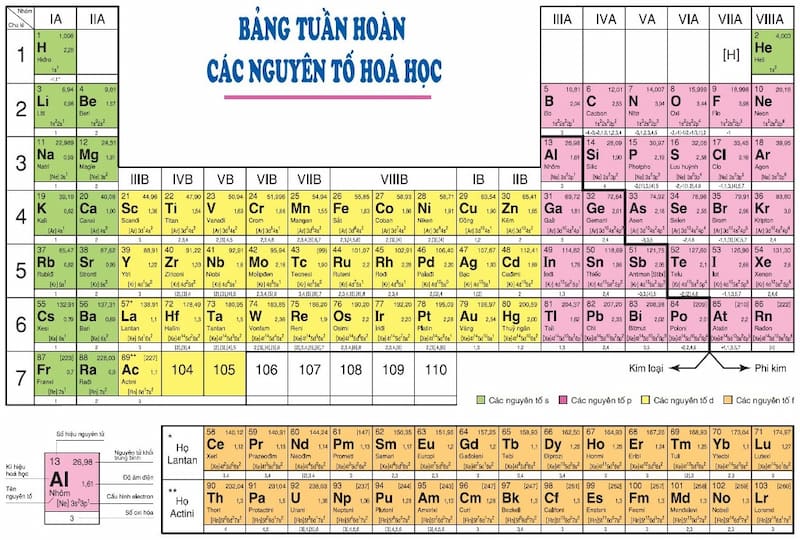
Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Hiện tại, bảng hệ thống tuần hoàn hóa học đã hoàn thiện với 118 nguyên tố. Các nguyên tố sẽ được sắp xếp từ trái qua phải, từ trên xuống dưới theo quy luật thứ tự tăng dần số hiệu nguyên tử. Vậy cấu tạo của bảng tuần hoàn các nguyên tố hóa học gồm có những gì?
Ô nguyên tố
Mỗi nguyên tố hóa học được xếp vào một ô của bảng gọi là ô nguyên tố. Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử của nguyên tố đó.
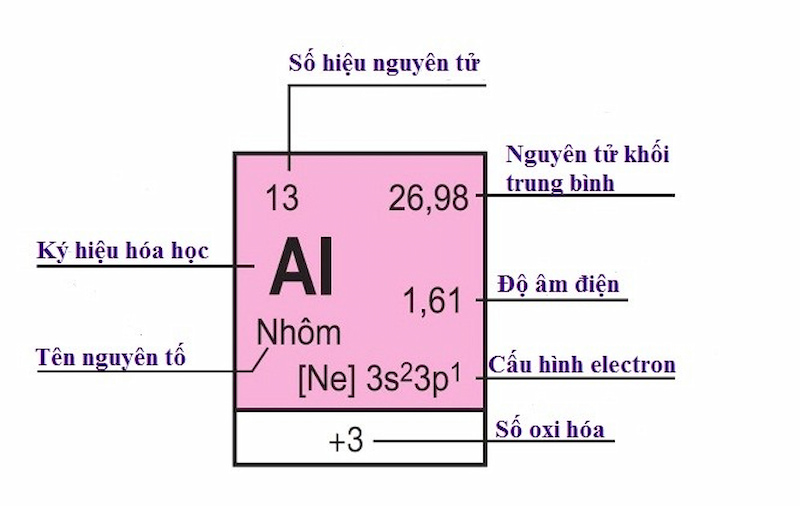
Ví dụ:
Nhôm (Al) chiếm ô 13 trong bảng tuần hoàn, vậy:
Số hiệu nguyên tử của Al là 13, số đơn vị điện tích hạt nhân là 13.
Số đơn vị điện tích hạt nhân là 13
Trong hạt nhân có 13 proton và vỏ nguyên tử của Al có 13 e.
Chu kì
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được sắp xếp theo chiều điện tích hạt nhân tăng dần.
Trong bảng tuần hoàn gồm 7 chu kỳ:
Chu kì 1: Gồm 2 nguyên tố H (Z=1) đến He (Z=2).
Chu kì 2: Gồm 8 nguyên tố Li (Z=3) đến Ne (Z=10).
Chu kì 3: Gồm 8 nguyên tố Na (Z=11) đến Ar (Z=18).
Chu kì 4: Gồm 18 nguyên tố K (Z=19) đến Kr (Z=36).
Chu kì 5: Gồm 18 nguyên tố Rb (Z=37) đến Xe (Z=54).
Xem thêm: Xem Bóng Đá Trên Truyền Hình Fpt Trực Tiếp Bóng Đá Trên Ứng Dụng Fpt Play
Chu kì 6: Gồm 32 nguyên tố Cs (Z=55) đến Rn (Z=86).
Chu kì 7: Bắt đầu từ nguyên tố Fr (Z=87) đến nguyên tố có Z=110, đây là một chu kì chưa hoàn thành.
Phân loại chu kì
Chu kì nhỏ: Các chu kì 1,2,3.
Chu kì lớn: Các chu kì 4,5,6,7.
Như vậy, chu kỳ được bắt đầu bằng 1 kim loại kiềm và kết thúc bằng 1 khí hiếm. Số thứ tự của chu kỳ bằng số lớp electron trong nguyên tử.
Lưu ý: Hai hàng cuối bảng là 2 họ nguyên tố có cấu hình e đặc biệt:
Họ Lantan: Gồm 14 nguyên tố đứng sau La(Z=57) thuộc chu kì 6.
Họ Actini: Gồm 14 nguyên tố sau Ac(Z=89) thuộc chu kì 7.
Nhóm nguyên tố
Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được sắp xếp thành một cột.
Bảng tuần hoàn các nguyên tố hóa học được phân loại thành 8 nhóm A (đánh số từ IA đến VIIIA) và 8 nhóm B (đánh số từ IB đến VIIIB). Trong đó, mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột. Nguyên tử các nguyên tố trong cùng một nhóm có số electron hóa trị bằng nhau và bằng số thứ tự của nhóm (trừ hai cột cuối của nhóm VIIIB).
Nhóm A:Nhóm A gồm 8 nhóm từ IA đến VIIIA.
Các nguyên tố nhóm A gồm nguyên tố s và nguyên tố p:
Nguyên tố s: Nhóm IA (nhóm kim loại kiềm, trừ H) và nhóm IIA (kim loại kiềm thổ).
Nguyên tố p: Nhóm IIIA đến VIIIA (trừ He).
STT nhóm bằng số e lớp ngoài cùng và bằng số e hóa trị
Cấu hình electron hóa trị tổng quát của nhóm A:
⟶ nsanpb
⟶ ĐK: 1≤a≤2; 0≤b≤6
Số thứ tự của nhóm A=a+b
⟶ Nếu a+b≤3 ⇒ Kim loại
⟶ Nếu 5≤a+b≤7 ⇒ Phi kim
⟶ Nếu a+b=8 ⇒ Khí hiếm
Ví dụ:
⟶Na(Z=11):1s22s22p63s1⇒IA
⟶O(Z=8):1s22s22p4⇒VIA
Nhóm B:Nhóm B gồm 8 nhóm được đánh số từ IIIB đến VIIIB, IB và IIB theo chiều từ trái sang phải trong bảng tuần hoàn.
Nhóm B chỉ gồm các nguyên tố của các chu kỳ lớn.
Nhóm B gồm các nguyên tố d và nguyên tố f (thuộc 2 hàng cuối bảng).
STT nhóm bằng số e lớp ngoài cùng và bằng số e hóa trị (Trường hợp ngoại lệ: Số e hóa trị = 9, 10 thuộc nhóm VIIIB)
Cấu hình electron hóa trị tổng quát của nhóm B:
⟶ (n−1)dansb
⟶ ĐK: b=2; 1≤a≤10
Số thứ tự của nhóm:
⟶ Nếu a+b 10 ⇒ STT nhóm = (a+b)−10
Sự biến đổi tính chất của các nguyên tố trong bảng tuần hoàn hóa học
Trong một chu kì (theo chiều tăng của điện tích hạt nhân) và trong một nhóm (theo chiều từ trên xuống dưới) có sự biến đổi tính chất được lặp lại ở các chu kì khác, nhóm khác theo cùng quy luật dưới đây.
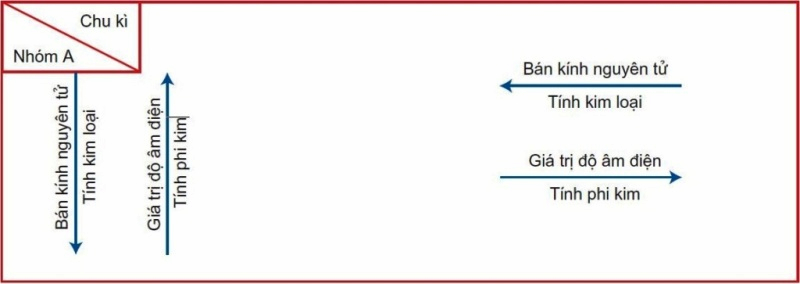
Trong một chu kì
Trong một chu kì, khi đi từ đầu chu kì đến cuối chu kì theo chiều tăng dần của điện tích hạt nhân, các nguyên tố trong bảng tuần hoàn hóa học có sự biến đổi như sau:
Số electron lớp ngoài cùng của nguyên tử tăng dần từ 1 đến 8 electron.
Tính kim loại của các nguyên tố giảm dần, đồng thời tính phi kim của các nguyên tố tăng dần. Đầu chu kì là một kim loại kiềm, cuối chu kì là halogen, kết thúc chu kì là một khí hiếm.
Ví dụ:
Trong chu kì 2, 3 ta nhận thấy:
Chu kì 2: Gồm 8 nguyên tố.
Số electron lớp ngoài cùng của nguyên tử các nguyên tố trong chu kì 2 tăng dần từ 1 đến 8 (Li ở nhóm I, Ne ở nhóm VIII).
Tính kim loại giảm dần và tính phi kim tăng dần: Đầu chu kì là một kim loại mạnh (Li), cuối chu kì là một phi kim mạnh (F), kết thúc chu kì là một khí hiếm (Ne).









